FORMATION ET DEVELOPPEMENT DE L’IMAGE PHOTOGRAPHIQUE
Auteur Pierre Glafkidès
Physique et chimie photographique

- Bains d’arrêt
- Bains d’arrêt tannants
- Contrôle des bains d’arrêt
- Bains durcissant au formol
- Dissolvants des halosels d’argent.
- Le fixage à l’hyposulfite
- Fixateurs acides
- Fixateurs tannants
- L’opération du fixage
Lire la partie 2 de Fixage, lavage et séchage
Lire la partie 3 de Fixage, lavage et séchage
Bains d’arrêt
Le bain d’arrêt, qui suit le bain de développement, freine rapidement l’action du révélateur sur la couche sensible, par neutralisation de l’alcali. La brusque diminution de pH qui en résulte abaisse l’énergie de développement en modifiant le potentiel d’oxydoréduction.
L’image développée est immergée 10 s dans la solution suivante, dont le pH doit rester inférieur à 5,8 :
- Eau 1 000 ml
- Acide acétique 40 ml
Pour les papiers, on peut réduire l’acide acétique jusqu’à 15 ml.A défaut d’acide acétique, utiliser du bisulfite de sodium liquide à raison de 50 à 100 m1/1, ou son équivalent le métabisulfite de sodium ou de potassium (25 à 50 g). Un autre produit susceptible d’emploi est le citrate monosodique à 5 ou 10 %. Pour empêcher le gonflement de la gélatine on ajoute du sulfate de sodium à la solution d’acide acétique, par exemple :
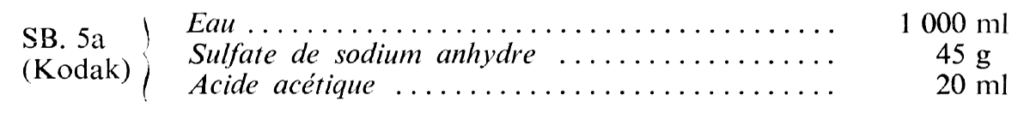
Durée d’immersion : 3 mn. -Température : jusqu’à 26° – Peut traiter 25 pellicules.
Bains d’arrêt tannants
Les bains d’arrêt tannants pour émulsions négatives se composent souvent d’une solution d’alun de chrome (utilisable jusqu’à 30°). On y plonge le film développé et l’agite fortement quelques secondes.

Durée d’immersion : 3 à 5 mn
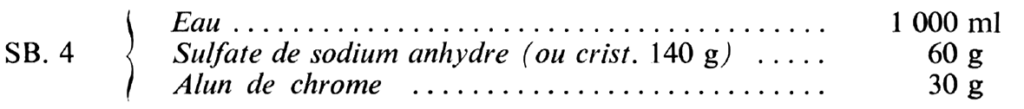
L’activité de ces bains diminue rapidement dès qu’ils sont utilisés. On doit les renouveler quand ils prennent une teinte vert jaune ou s’ils se couvrent d’écume, c’est-à-dire après quelques jours seulement.
L’alun de chrome est un sulfate double de chrome et de potassium Cr2(SO4)31+K2SO4+24 H2O. Il cristallise en octaèdres réguliers de teinte violette. Il est isomorphe de l’alun d’aluminium Al2(SO4)3 +K2SO4-1-24 H2O, ou alun ordinaire, qui possède également des propriétés tannantes vis-à-vis de la gélatine.
L’alun de chrome donne des ions Cr(H20)6+++ violets qui, par acidification, deviennent lentement verts Cr(H20)5(OH)++, et l’alun d’aluminium, des ions complexes hydratés tels que Al(H20)6+++, Al(H20)50H++, Al(H20)4(OH)2+, Al(H20)3(OH)3, qui sont les facteurs du tannage de la gélatine. Ces ions peuvent former avec les groupes carboxylés de la molécule de gélatine des complexes de coordination. Les complexes se détruisent quand ils se trouvent en présence d’ions citriques ou tartriques à plus grande tendance de coordination, ce qui leur fait perdre leur pouvoir tannant. Baumbach et Gausman ont émis l’hypothèse que les molécules d’eau étant polaires se fixent toujours sur des groupes également polaires ; or on réduit le nombre de groupes ioniques par coordination avec les ions complexes aluminium. Le gonflement de la gélatine se trouve ainsi diminué.
La nécessité d’avoir à la fois un grand nombre d’ions Cr à charge positive et un grand nombre de groupes carboxyles de gélatine à charge négative, impose deux conditions antagonistes qui réduisent l’intervalle de pH où le tannage est possible. En effet les ions chrome perdent leur charge positive à pH dépassant 4,6.
Spiers avait déjà admis, en 1934, que les atomes de chrome lient les chaînes polypeptidiques par un groupe carboxyle et un groupe aminé. Aux acidités moyennes, qui correspondent au point isoélectrique de la gélatine, la chaîne polypeptidique est pelotonnée, ce qui favorise la formation de ponts intermédiaires, donc le tannage (1).
Contrôle des bains d’arrêt.
Les bains d’arrêt se conservent indéfiniment en flacons bouchés. En cuve, leur durée de vie moyenne est d’un mois. En cuvette elle est beaucoup plus courte : 3 jours pour les bains à l’acide acétique et un jour pour ceux à l’alun de chrome. Ils peuvent traiter les surfaces suivantes :
bain à l’acide acétique : 56 dm2 – bain acétique dilué : 100 dm2 de papier –
SB. 5.a : 150 dm2 – SB. 3 : 32 dm2 – SB. 4 : 32 dm2.
Le bain SB. 5a est généralement préféré pour les travaux d’amateurs.
Il est possible de calculer l’état d’un bain d’arrêt, en fonction du volume de bain emporté et de la quantité d’acide introduit, par les équations de Herzberger et Henn (2), mais, dans la pratique, on opère d’une façon empirique. Henn et Crabtree (3) conseillent d’ajouter Il ml d’acide acétique à 10 par bobine sortie. Pour une cuve de 120 1, il faut 5 1 d’acide acétique cristallisable, après traitement de 5 000 bobines. Le bain est rejeté après passage de 35 000 bobines.
La mesure du pH permet de contrôler facilement l’état d’activité d’un bain d’arrêt. A défaut d’appareil, on peut se contenter d’un indicateur coloré. Le pH doit être voisin de 4 quand le bain est neuf, toujours inférieur à 4,7 quand il contient de l’alun de chrome, et être aux environs de 5 en cours d’utilisation s’il est à l’acide acétique (5,5 pour les épreuves). Les indicateurs colorés recommandés sont les suivants (4) :
- Vert de bromocrésol (bain à l’acide acétique pour les négatifs) : jaune quand le bain est neuf, vert quand il est en bon état, bleu s’il n’est pas suffisamment acide.
- Pourpre de bromocrésol (pour les épreuves) : jaune quand le bain est neuf, orangé quand il est en bon état, pourpre s’il est trop peu acide.
- Risso-Dominguez (5) a indiqué le rouge Congo et le rouge d’alizarine S.
Rouge Congo : bleu à pH : 3, rouge à pH : 5.
Rouge d’alizarine S : jaune à pH : 3,7 et rose à pH : 5,2.
Un papier imprégné de rouge Congo paraît noir ou incolore, vu en lumière rouge, suivant que le bain est suffisamment acide ou non.
Bains durcissants au formol.
Le formol (6) quand il est en milieu alcalin, est un durcissant très actif de la gélatine. On peut l’utiliser soit en bain durcissant préalable, avant le développement, pour tanner à fond la gélatine de l’émulsion, soit après développement, soit après lavage.
Bain de durcissement préalable (avant développement)

Le Benzotriazol, qui est un antivoile, peut être remplacé par du nitrate de 6-nitrobenziminazol (7). La dose doit être doublée si on développe à 42°.
Les films sont laissés 10 mn dans ce bain puis rincés 30 s. Les durées de développement sont alors les suivantes :
- A 24°, même temps qu’à 18°.
- A 29°, temps réduit à 70 %.
- A 32°, temps réduit à 60 %.
- A 35°, temps réduit à 50 %.
- A 43°, temps réduit à 25 %.
La formule IH.5 (Ilford) comporte : sulfate de sodium crist. 200 g, carbonate de sodium 4,6 g, formol à 40 % 25 ml, pour 1 litre. Durée d’immersion : 3 mn. Utilisé après développement ou après fixage, ce bain peut faire réticuler la gélatine,
Bain de durcissement, après lavage. — Pour les papiers dont l’émulsion est insuffisamment durcie, parce que trop récente, il suffit de les tremper 2 mn dans une solution de formol à 5 % puis de les rincer 3 mn. L’addition d’un alcali (carbonate) renforce considérablement l’action tannante.
Les films destinés à être affaiblis ou renforcés sont durcis 3 mn dans le bain suivant :
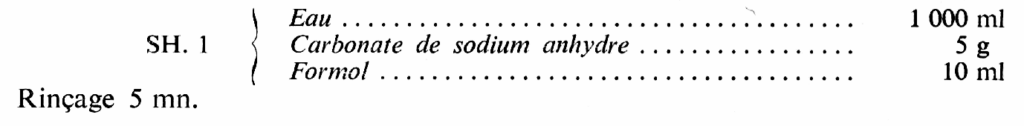
Dissolvants des halosels d’argent
La dissolution du bromure d’argent inattaqué, restant après le développement, porte le nom de fixage. Cette opération rend le phototype transparent et assure sa conservation, en évitant tout noircissement ultérieur.
La solubilisation de l’halosel d’argent se fait par transformation en sel complexe double d’argent et métal alcalin, lequel est susceptible d’être éliminé par lavage à l’eau.
Les halogénures d’argent (chlorure, bromure, iodure) sont solubles dans un certain nombre de composés, minéraux pour la plupart, parmi lesquels il faut citer, outre l’hyposulfite de sodium :
L’ammoniaque NH4OH, solvant du chlorure d’argent AgCI. Il se forme le chlorure d’un ion complexe argenti-ammonium, soluble. Par évaporation, la solution perd lentement son ammoniaque et laisse déposer des cristaux octaédriques de chlorure d’argent. L’ammoniaque à 4 % dissout le chlorure d’argent en 2 à 5 mn. Elle a moins d’action sur le bromure et n’attaque pas l’iodure. On peut remplacer l’ammoniaque par le carbonate neutre d’ammonium.
Bromure de potassium KBr. En solution concentrée, il dissout le chlorure et le bromure d’argent ; il agit plus lentement sur l’iodure. Comme il attaque fortement la gélatine on ne peut l’utiliser qu’en présence d’un agent durcissant :
- Eau 1 000 ml
- Bromure de potassium 350 g
- Alun ordinaire 10 ml
Durée d’immersion : une dizaine de minutes.
Avec le bromure d’argent, il se forme un bromure double d’argent et de potassium AgBr, KBr, soluble.
Iodure de potassium KI. En solution concentrée, il dissout les chlorure, bromure et iodure d’argent : rapidement l’iodure et le chlorure, quatre fois moins vite le bromure. La gélatine se gonfle et se désagrège en l’absence d’agent durcissant ; dans tous les cas, l’image à l’état humide se présente en relief. La formule suivante peut être utilisée :

Prendre 5 parties de A pour 1 partie de B. Durée d’immersion 5 à 10 mn pour l’iodure d’argent. Au bout de quelques jours, le bain se colore en brun par mise en liberté d’iode ; il teinte alors la gélatine.
Sulfocyanure de potassium K.SCN. Il ne dissout bien que le chlorure et le bromure d’argent, avec formation d’un sulfocyanure double d’argent et de potassium :
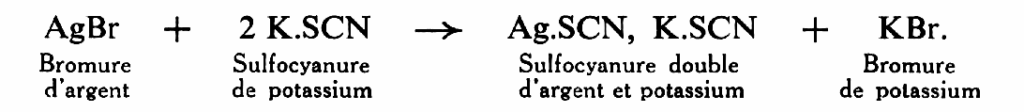
On ne doit employer le sulfocyanure qu’en solutions relativement diluées :
- Eau 1 000 ml
- Sulfocyanure de potassium 50 g
- Alun ordinaire 10 g
Durée d’immersion : 2 à 5 mn. On rince ensuite le phototype dans un bain neuf avant de le laver à l’eau, pour éviter que le sel double ne précipite dans la gélatine.
Le sulfocyanure d’ammonium est utilisé comme fixateur dans le bain de stabilisation des papiers « Autopositive » Kodak.
Le cyanure de potassium et le ferrocyanure de potassium sont également des solvants des halogénures d’argent. Le cyanure est particulièrement actif mais trop toxique pour être pratiquement utilisé ; il forme du cyanure double Ag.CN, K.CN, et désagrège la gélatine.
Le chlorure de magnésium MgC12, le sulfite de sodium Na2SO3, la thiourée CS.(NH2)2 et la thiosinamine (ou allylthiourée) NH2.CS.NH— CH2— CH — CH2 ne dissolvent bien que le chlorure d’argent.
Le chlorure de magnésium et la thiourée attaquent la gélatine. En présence de nitrate d’argent, la thiourée donne un précipité insoluble qui reste dans la couche gélatinée.
La thiosinamine est plus facile à. utiliser : une solution à 1 % légèrement acidifiée, dissout le chlorure d’argent en 5 mn.
II a été proposé ces dernières années, toute une série de dérivés sulfurés organiques susceptibles de dissoudre les sels d’argent en formant des complexes. On a eu surtout en vue leur utilisation dans les monobains et la stabilisation. On doit citer les mercaptopyrimidines (Dreywood, Br. Amer. 2.525.532, 1950), l’acide éthylène-bis-thioglycolique HOOC— CH2— S— CH2— CH2— S— CH2— COOH (Mader et Kodak, Br. Fr. 1.131.908, 1955) solvant sélectif du chlorure d’argent, l’acide mercaptosuccinique (Haist et coll. : Phot. Eng., 1956, p. 182-189), les inonothioglycérol, acide thiobarbiturique, et g-mercaptoéthylamines (Haist et King : Br. Amer. 2.875.048, 1959).
Le plus simple est l’acide thioglycolique (ou mercapto-acétique) SH—CH2—COOH dont l’action est sensible aux variations de pH et de température. Il y a encore l’acide thiosalicylique (ou o-mercaptobenzoïque) dont l’action augmente avec la température, 1a cystéine (ou acide ot-amino-gmercaptopropionique), plus efficace que l’acide thioglycolique à pH 10,5, niais pratiquement égale à pH 12. La thioglycérine est aussi plus efficace que l’acide thioglycolique. En fait, ce dernier est le seul produit que l’on puisse se procurer facilement dans le commerce.
Voici d’après Haist, King et Bassage (Phot. Sci. Engng., juill. 1961, pp. 198-203) les temps de clarification en secondes à divers pH et diverses températures d’un film positif (en comparaison avec les thiosulfates) :

Le fixage à l’hyposulfite
Le fixateur utilisé dans la pratique courante est presque toujours le thiosulfate ou hyposulfite de sodium Na2S2O3, 5 H2O (indiqué par Herschel) qui dissout bien le chlorure et le bromure et n’attaque ni la gélatine ni l’image d’argent. Le bromure d’argent se combine à l’hyposulfite en donnant des argentithiosulfates (8) suivant la réaction :
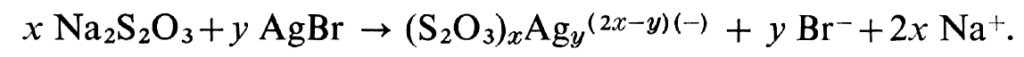
Les ions thiosulfate, adsorbés à la surface des grains, forment le complexe Na [Ag(S203)] qui, en présence d’un excès de thiosulfate, se transforme en Na3[Ag(S203)2] soluble. De nombreuses autres combinaisons ont été admises, et il est certain qu’un excès d’ions Ag+ provoque la formation d’argentithiosulfates insolubles. Mais, en premier lieu, la dissolution de l’halogénure est ralentie, et c’est ce qui arrive avec les bains fixateurs usés. Il est conseillé de les rejeter quand la durée de fixage, par rapport au bain neuf, a doublé.
(8) Ces ions complexes ont été constatés par Barth en 1892 (Zeits Phys. Chem., 1892, p. 216) puis précisés par H. Baines qui les prépara par action du thiosulfate de sodium sur le carbonate d’argent (Se. Ind. Phot., [1], t. 9R, p. 176 et [2], t. 1, p. 93). Voir aussi : Pouradier et Chateau : Sc. Ind. Phot., [2], t. 24, p. 129, et H. Bains : JI. Phot. Sci., décembre 1955, pp. 175-179 ou Sc. Ind. Phot., avril 1956, pp. 145-147. L’influence de l’adsorption a été mise en évidence par James et Vanselow en faisant déplacer des merocyanines adsorbées sur AgBr, par une solution de thiosulfate. D’ailleurs on sait, par l’accélération du fixage par les cations actifs (Abribat et Pouradier : Sc. Ind. Phot., [2], t. 24, p. 473) que cette influence est très importante.
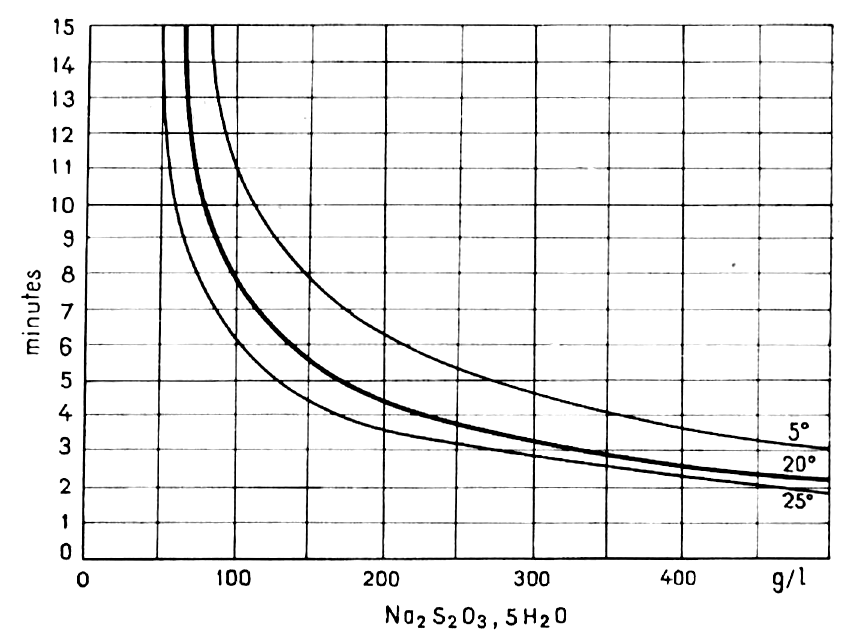
La vitesse du fixage est optimale à partir d’une teneur en thiosulfate de 20%. Elle croît ensuite lentement avec la concentration (fig. 36).
Les complexes formés dans un fixateur ne sont pas seulement les thiosulfates. Avec les émulsions contenant du chlorure d’argent et traitées avec des fixateurs bisulfités, il peut se former des complexes de sulfite solubles, en petites quantités cependant, car un litre de bisulfite à 1,5 M ne dissout que 71 mg de AgCI à pH 3,5 (9).
Le fixage d’une couche sensible se produit par une double diffusion à travers la gélatine : celle de thiosulfate vers les grains de bromure d’argent et celle, en sens inverse, des argentithiosulfates formés, vers la partie liquide. L’agitation accélère le phénomène. Il en est de même quand une couche au repos est mise à fixer, face gélatinée tournée vers le bas : les sels complexes, plus lourds, migrent par gravité. Si la gélatine est gonflée, l’augmentation du chemin à parcourir compense pratiquement l’activation de la diffusion (10).

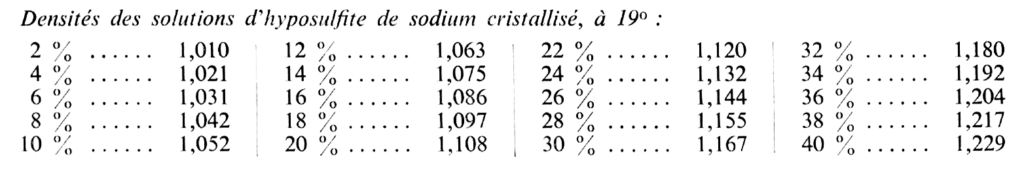
Hyposulfite de sodium : L’hyposulfite (ou thiosulfate) de sodium se présente sous forme de cristaux transparents de forme caractéristique (prismes clinohombiques), d’une saveur amère et très solubles dans l’eau. La dissolution se fait avec abaissement de température. C’est pourquoi il vaut mieux préparer les fixateurs avec de l’eau tiédie dans laquelle on verse l’hyposulfite (on laisse refroidir avant d’ajouter le métabisulfite). Le sel cristallisé à 5 H2O fond à 48° et se déshydrate en hyposulfite anhydre Na2S203 dont 0,64 g équivalent à 1 g de produit cristallisé.
L’hyposulfite est obtenu par ébullition d’une solution de sulfite de sodium avec du soufre, suivant la réaction :
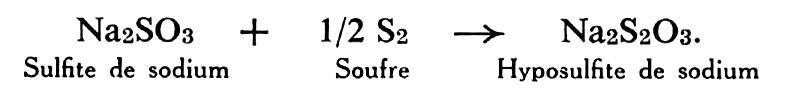
On filtre, évapore et cristallise.
On le prépare accessoirement par action du gaz sulfureux S02 sur le sulfure de calcium CaS ; il se produit de l’hyposulfite de calcium que l’on transforme en hyposulfite de sodium par le carbonate de sodium.
L’hyposulfite se forme par ébullition d’un excès de fleur de soufre dans une solution de soude caustique. Après filtration, on traite par le gaz sulfureux jusqu’à décoloration, puis fait cristalliser après évaporation.
On l’obtient aussi en fondant 100 parties de carbonate hydraté avec 30 parties de soufre en poudre. On reprend par l’eau, fait bouillir le sulfite formé avec une nouvelle quantité de soufre, filtre et fait cristalliser.
Enfin une solution à 20% d’hyposulfite peut être obtenue par action du bisulfite sur l’amalgame de sodium (11).
Hyposulfite anhydre : Kendall et Axford (12) l’ont préparé en faisant cristalliser la solution aqueuse en présence d’un solvant organique.
Fixateurs acides
L’alcali du révélateur entraîné par la couche photographique, est susceptible de décomposer l’argentithiosulfate soluble avec formations de tâches. De plus, la substance réductrice du révélateur continue à s’oxyder dans le bain de fixage en donnant des composés colorants.
Les acides décomposent, d’autre part, l’hyposulfite en soufre S et anhydride sulfureux S02. se forme ensuite de l’hydrogène sulfuré H2S et de l’acide trithionique Na2S306. L’action de S sur S02 donne, par ailleurs, naissance à de l’acide pentathionique :
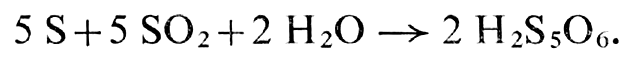
Une étude racliochimique a montré que les deux atomes de soufre du thiosulfate ne sont pas équivalents (13).
On empêche la décomposition des bains de fixage en leur ajoutant du bisulfite de sodium (ou son équivalent, le métabisulfite), ainsi qu’une petite quantité de sulfite. Il se forme ainsi un tampon entre l’hyposulfite d’une part et les alcalis, et les acides d’autre part. Le bisulfite neutralise l’alcali du révélateur en donnant du sulfite, tandis que le sulfite se transforme en bisulfite par les acides, avant que l’hyposulfite puisse donner naissance à du soufre et de l’anhydride sulfureux.
Si on oxyde, par l’iode, l’hyposulfite en tétrathionate et le sulfite en sulfate, il reste le trithionate, qui, par ébullition en présence de chlorure de baryum, se décompose en acide sulfurique (sous forme de BaSO4), soufre et S02, d’où une méthode de dosage de l’acide trithionique (14) :
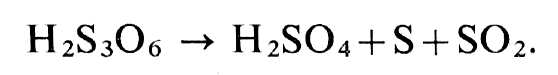
En solution neutralisée, le sulfite dédouble le pentathionate, contenu par une solution d’hyposulfite, en trithionate et hyposulfite.

Par dosage du trithionate formé on connaît la quantité de pentathionate.
Un bain de fixage acide se compose comme suit (200 g d’hypo pour les papiers et 300 g pour les films rapides et radio) :

Durée de fixage à 300 g d’hyposulfite : 3 à 10 mn
Le sulfite est souvent omis à tort. Avec 350 g d’hyposulfite par litre, il faut porter la quantité de bisulfite à 70 ml. D’autre part, ce dernier peut être remplacé, dans la formule ci-dessus par 25 à 30 g de métabisulfite. Enfin, il est possible de substituer au bisulfite un mélange équivalent de 21 g de sulfite neutre anhydre et de 14 g d’acide sulfurique, préalablement dissous dans 200 ml d’eau.
250 g d’hyposulfite cristallisé peuvent être remplacés par 157 g d’hyposulfite anhydre.
Le bain ci-dessus peut fixer 60 dm2/l, sans bain d’arrêt, et 90 dm2, avec bain d’arrêt intermédiaire. Il se conserve trois mois en flacons bouchés, un mois et une semaine encore en cuvette.
Vitesse de fixage : La vitesse de fixage est maximale pour une concentration de 30 %. Elle augmente avec la température, 2,3 fois tous les 10°.
Fixateurs tannants
Les fixateurs sont rendus tannants par addition d’alun ordinaire (d’aluminium) ou d’alun de chrome.
Pour que l’alun conserve ses propriétés durcissantes, il faut que le pH du bain ne dépasse pas 6,3 pour l’alun ordinaire et 4,7 pour l’alun de chrome. D’autre part, le pH ne peut être inférieur à 3,7 car en solution plus acide l’hyposulfite se décomposerait. Aussi pour régulariser le pH du bain, par effet tampon, on emploie du sulfite neutre en proportion maximum de 20 g/l. L’acidité est fournie par le bisulfite ou le sulfate acide de sodium NaHSO4, dans le cas de l’alun de chrome et par les acides acétique et borique et le sulfate acide de sodium dans le cas de l’alun ordinaire.
Bains fixateurs tannants à l’alun ordinaire : La quantité d’alun est de 10 à 50 g/l. Au-delà, les clichés deviennent opalescents. Comme tampon on emploie l’acétate de sodium NaCH3CO2. De plus, ce dernier, avec l’acide borique, retarde la formation de boue dans le bain. En présence du tampon d’acétate, la quantité de sulfate acide de sodium peut être assez élevée sans risque de décomposition de l’hyposulfite.
Les formules suivantes, étudiées par Woolsey et Pankhurst, donnent de bons résultats ( l5). Les bains se conservent trois mois. Les voici, comparées à deux formules Ilford et Gevaert.

On dissout d’abord à 50° l’hyposulfite, puis, successivement, le sulfite, l’acétate et l’acide borique. On dissout à part, à 50°, le sulfate acide de sodium et l’alun ; cette solution est versée dans la première en agitant ; le tout est ensuite complété à un litre. Dans les formules contenant de l’acide acétique, celui-ci est ajouté après le sulfite ; on dissout ensuite l’acide borique et l’alun, éventuellement à part dans un peu d’eau chaude.
D’autres formules comportent seulement une solution de réserve contenant du sulfite, de l’acide acétique et de l’alun. Par exemple, IF.13 (Ilford) Papiers est constituée de 50 g de sulfite, 75 ml d’acide acétique et 100 g d’alun pour un litre. Au moment de l’emploi on met 125 ml de cette solution dans un litre d’eau contenant 200 g d’hyposulfite. Pour préparer la solution IF.13 on dissout le sulfite dans 200 ml d’eau chaude, laisse refroidir, ajoute l’acide acétique lentement et verse l’alun préalablement dissous à chaud dans 600 ml d’eau (refroidie ensuite).
Pour la préparation de doses sèches à dissoudre au moment de l’emploi, on utilise de l’hyposulfite anhydre, du sulfite, de l’acétate de soude et de l’acide borique. L’alun et le sulfate acide de sodium sont placés dans un paquet séparé.
Au fur et à mesure de son usure, le pH du bain tannant augmente et ses propriétés durcissantes diminuent : quand le pH passe de 4,5 à 7, la durée de l’opération est triplée.
Bains fixateurs tannants à l’alun de chrome : Ces bains durcissent davantage la gélatine, le point de fusion devenant plus élevé qu’avec l’alun ordinaire. Mais le pouvoir durcissant est plus sensible aux variations de pH. L’acétate de sodium réduit ce pouvoir. Par ailleurs, les boues n’ayant pas tendance à précipiter, l’acide borique devient inutile. Les bains à l’alun de chrome se conservent moins que ceux à l’alun ordinaire (une semaine).
Formules à l’alun de chrome

L’alun de chrome est dissous séparément dans 250 ml d’eau puis ajouté au restant des produits en solution en agitant. Le bain B est indiqué pour le développement sur machine : après fixage de 150 m de film, on ajoute 10 1 de bain neuf à 140 1 restants de bain vieux, et ainsi de suite. La formule C peut se préparer en doses sèche. L’alun de chrome est mis à part ; l’hyposulfite cristallisé est alors remplacé par de l’hyposulfite anhydre.
La température des bains tannants ne doit pas dépasser 21°.
L’opération du fixage
Quand on plonge une couche photographique dans un bain de fixage, celle-ci devient transparente au bout de quelques minutes, toute apparence laiteuse ayant disparu. A ce moment il peut rester encore du bromure d’argent dans la gélatine. Pour qu’il en reste moins de 0,25 %, il faut continuer l’opération pendant une durée au moins égale à celle nécessitée pour obtenir la transparence (16). Pratiquement, on prolonge la durée de fixage légèrement au-delà du double de celle-ci (temps d’éclaircissement x 2). Du thiosulfate se fixe à la surface des grains d’argent, d’une façon irréversible. Par blanchiment de ces grains d’argent, il se forme du sulfure d’argent qu’on peut mettre en évidence à l’aide d’éléments radioactifs (17).
La vitesse de dissolution du bromure d’argent dépend d’un grand nombre de facteurs : épaisseur et grain ; teneur en halosel de la couche sensible ; teneur en iodure d’argent, celui-ci retardant le fixage ; température (18), agitation, usure du bain, sans parler de la concentration en hyposulfite dans la formule initiale : nous avons vu que celle-ci varie entre 20 et 35 %, avec un optimum à 30 %.
Epuisement des bains de fixage : Quand le temps d’éclaircissement dépasse le double du temps initial, le bain est considéré comme usé. Une goutte de ce bain, étendue sur du papier, et exposée à la lumière, brunit quand le fixateur est épuisé. Une épreuve fixée, lavée une heure et sulfurée dans du monosulfure à 0,2 % doit être exempte de voile.
Un litre de bain peut fixer environ 1 m2 de surface négative et 2 m2 de papier. Les bains à l’alun de chrome s’épuisent plus vite que ceux à l’alun ordinaire surtout s’il n’y a pas de bain d’arrêt intermédiaire.
Contrôle de l’acidité : Les limites d’acidité sont différentes pour chaque catégorie de bains fixateurs. Le pH limite supérieur est 6,3 pour ceux à l’alun ordinaire et 4,7 pour ceux à l’alun de chrome.
Un fixateur à l’alun ordinaire trouble doit être rejeté. Mais on peut retarder sa neutralisation par addition de 1/3 de la quantité normale d’acide acétique (préalablement dilué). Cette opération ne peut être répétée que trois fois.
Les fixateurs à l’alun de chrome ne peuvent être réacidifiés.
Le pH des bains peut être contrôlé avec un appareil, ou, à défaut, à l’aide d’indicateurs colorés. J. Rzymkowski (19) a proposé des indicateurs fluorescents tels que la pyranine qui, au delà de pH 7, devient jaune avec fluorescence verte. Dose : 20 ml de colorant à 0,1 %, par litre de bain. La fluorescence peut être provoquée par un tube immergé à phosphorescence bleue (Permaphan de Auergesellschaft, Berlin). Au noir, on voit une fluorescence intense autour du tube quand le bain devient alcalin.
1- Pouradier, Roman, Venet, Chateau et Accary : Bull. Soc., décembre 1952, pp. 928-937.D.A. Plant : JI. Soc. Leather Tr. Chem., novembre 1952, pp. 351-357.
2- Herzberger et Henn : Sc. et Ind. Phot., t. 18 (2), p. 337.
3- R.W. Henn et J.1. Crabtree : JI. Phot. Soc. Amer., février 1951, pp. 13-18.
4- R.W. Henn et J.I. Crabtree : JI. Phot. Soc. Amer., novembre 1953, pp. 140-145.
5- C.J. Risso-Dominguez : JI. Phot. Soc. Amer., avril 1951, pp. 58-60.
6- Le formol, ou aldéhyde formique H.CHO, se présente sous forme de liquide incolore constitué par la solution aqueuse à 40 ou 35 % de gaz formique. Son odeur est suffocante. Il se polymérise en trioxyméthylène (H.CH0)3 qui précipite en flocons blancs ; on les décompose par chauffage en aldéhyde simple.
7- 1 g de nitrate de 6-nitrobenziminazol se dissout dans 200 ml d’eau distillée contenant déjà I g de soude caustique.
9- Chateau et coll. : Sc. Ind. Phot., juillet 1956, pp. 257-262.
10- Chateau et Pouradier : Sc. et Ind. Phot., 1953, p. 129. — H. Baines : JI. Phot. Sc., décembre 1955, pp 175-179, et Sc. et Ind. Phot., avril 1956, t. 27, pp. 145-147.
11- Br. Fr. 825.226 (1937).
12- Dimsdale, Kendall et Axford (Ilford) Br. Angl. 737.295 (1953).
13- R.E. Davis : JI. Amer. Chem. Soc., 20 juillet 1958, pp. 3565-35-69.
14- E. Gruenthal : JI. Phot. Soc. Amer., septembre 1951, pp. 90-95 (d’après Thèse à Berlin).
15- D.P. Woolsey et A. Pankhurst : Phot. JI., t. 82, 1942, p. 12.
16- Le bromure d’argent se dissout rapidement au début, puis de plus en plus lentement, suivant une courbe exponentielle.
17- P.A. Block et G.W. Steves : JI. Phot. Sci., septembre 1961, pp. 330-334.
18- Tous les bains photographiques doivent avoir, autant que possible, une température uniforme, sinon il peut se produire une réticulation de la gélatine par passage d’un bain froid à un bain chaud ou vice versa.
19- J. Rzymkowski : Sc. Ind. Phot., juin 1952, p. 245.